Percobaan I
Senin, 15 Oktober 2012
I. TUJUAN
Ø Mengidentifikasi senyawa
asam karboksilat dan ester
Ø Mempelajari sifat fisik dan kelarutan dari senyawa tersebut
Ø Mempelajari cara pembuatan ester (esterifikasi)
Ø Mengetahui
serta memahami reaksi-reaksi gugus karboksilat dalam suatu senyawa
Ø Untuk mempengaruhi variable-variabel yang
berpengaruh pada percobaan esterifikasi
II. DASAR TEORI
Esterifikasi adalah salah satu jenis reaksi
dimana reaksi tersebut untuk menghasilkan ester. Ester merupakan sebuah
hidrokarbon yang diturunkan dari asam karboksilat. Sebuah asam karboksilat
mengandung gugus -COOH, dan pada sebuah ester hidrogen di gugus ini
digantikan oleh sebuah gugus hidrokarbon dari beberapa jenis. Ester dapat
dihasilkan dengan cara mereaksikan antara sebuah alcohol dengan asam
karboksilat
Variabel yang berpengaruh adalah
1. Suhu
Hal ini dikarenakan sifat dari reaksi yang
eksotermis dan suhu dapat mempengaruhi harga konstanta kecepatan reaksi
2. Perbandingan zat pereaksi
Dikarenakan sifatnya
reversible maka salah satu pereaktan harus dibuat berlebih agar optimal dalam
pembentukan produk ester yang ingin dihasilkan
3. Pencampuran
Dengan adanya pengadukan
saat pencampuran maka molekul-molekul pereaktan dapat mengalami tumbukan yang
lebih sering sehingga reaksi dapat berjalan lebih optimal
4. Katalis
Sifat reaksi
esterifikasi yang lambat membutuhkan katalis agar berjalan lebih cepat
5. Waktu reaksi
Jika waktu saat reaksi lebih lama maka
kesempatan molekul-molekul untuk bertumbukan semakin lebih sering
Suatu asam karboksilat adalah suatu
senyawa organik yang mengandung gugus karboksil, –COOH. Gugus karboksil
mengandung gugus karbonil dan sebuah gugus hidroksil; antar aksi dari kedua
gugus ini mengakibatkan suatu kereaktifan kimia yang unik dan untuk asam
karboksilat (Fessenden, 1997). Adapun sifat-sifat yang dimiliki oleh asam
karboksilat adalah:
Adapun sifat-sifat yang dimiliki
oleh asam karboksilat adalah:
1. Reaksi Pembentukan Garam
Garam organik yang membentuk dan
memiliki sifat fisik dari garam anorganik padatannya, NaCl dan KNO3adalah garam
organik yang meleleh pada temperatur tinggi, larut dalam air dan tidak
berbau. Reaksi yang terjadi adalah:
HCOOH + Na+ → HCOONa + H2O
2. Reaksi Esterifikasi
Ester asam karboksilat ialah
senyawa yang mengandung gugus –COOR dengan R dapat berbentuk alkil. Ester dapat
dibentuk berkat reaksi langsung antara asam karboksilat dengan alkohol. Secara
umum reaksinya adalah:
RCOOH + R’OH → RCOOR + H2O
3. Reaksi Oksidasi
Reaksi terjadi pada pembakaran
atau oleh reagen yang sangat kokoh dan kuat seperti asam sulfat, CrO3,
panas.Gugus asam karboksilat teroksidasi sangat lambat.
4. Pembentukan Asam Karboksilat
Beberapa cara pembentukan asam
karboksilat dengan jalan sintesa dapat dikelompokkan dalam 3 cara yaitu: reaksi
hidrolisis turunan asam karboksilat, reaksi oksidasi, reaksi Grignat
(Fessenden, 1997).
Asam karboksilat, dengan basa
akan membentuk garam dan dengan alkohol menghasilkan eter. Banyak dijumpai
dalam lemak dan minyak, sehingga sering juga disebut asam lemak. Pembuatannya
antara lain melalui oksidasi alkohol primer, sekunder atau aldehida, oksidasi
alkena, oksidasi alkuna hidrolisa alkil sianida (suatu nitril) dengan HCl
encer, hidrolisa ester dengan asam, hidroilisa asil halida, dan reagen
organolitium (Wilbraham, 1992).
Asam asetat (CH3COOH) sejauh ini
merupakan asam karboksilat yang paling penting diperdagangan, industri dan
laboratorium. Bentuk murninya disebut asam asetat glasial karena senyawa ini
menjadi padat seperti es bila didinginkan. Asam asetat glasial tidak berwarna,
cairan mudah terbakar (titik leleh 7ºC, titik didih 80ºC), dengan bau pedas
menggigit. Dapat bercampur dengan air dan banyak pelarut organik (Fessenden,
1997).
III. ALAT DAN BAHAN
IV. PROSEDUR KERJA
A. Karboksilat
B. Esterifikasi
V. HASIL PERCOBAAN

VI. PEMBAHASAN
Pada
percobaan kali ini bertujuan untuk mengidentifikasi terbentuknya asam
karboksilat dan ester. Berdasarkan hasil percobaan yang
pertama adalah identifikasi asam karboksilat yaitu asam salisilat (C6H7O3)
ditambahkan dengan air yang tidak terjadi reaksi apapun karena asam salisilat
tersebut tidak dapat larut dengan air, yang disebabkan bahwa asam salisilat
merupakan asam karboksilat suku tinggi (C > 5) yang tidak dapat larut dalam
air biasa ataupun air panas.
a. C6H7O3+
H2O ---------> tidak larut
b. C6H7O3+
H2O (dipanaskan)
---------> tidak
larut
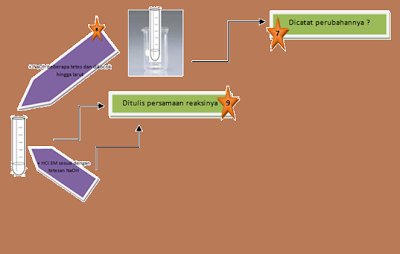
Setelah dipanaskan endapan tersebut didinginkan dengan
aquades (pada suhu ruang) sehingga terjadi pembekuan endapan atau
pengkristalan.
Kemudian endapan tersebut ditambahkan dengan NaOH 3M
sebanyak 50 tetes yang dilakukan tetes demi tetes untuk melarutkannya. Pada percobaan
ini asam karboksilat bereaksi dengan basa kuat membentuk garam yang dapat larut.
Proses reaksi tersebut biasa dikenal dengan reaksi saponifikasi.
A
Setelah larut, larutan tersebut
ditambahkan HCl 3M sebanyak 50 tetes
(yang disesuaikan dengan banyaknya NaOH yang digunakan) serta berfungsi untuk
mengetahui banyaknya NaOH yang tersisa dalam proses saponifikasi. Disamping itu
penambahan HCl juga untuk memberikan suasana asam, karena hasil mula-mula dari
reaksi saponifikasi adalah berupa karboksilat, dengan adanya penambahan HCl ini
karboksilat diubah menjadi asam karboksilat.
Selanjutnya melakukan
percobaan esterifikasi yang menggunakan larutan etanol dan butanol. Berdasarkan
hasil percobaan diperoleh bahwa Etil asetat disintesis melalui reaksi esterifikasi
fischer dari asam asetat dan etanol yang seharusnya hasil percobaan beraroma pisang(perisa sintesis), biasanya
dalam sintesis disertai katalis asam seperti asam sulfat. Akan tetapi pada
percobaan yang dilakukan tidak terdapat bau ester yang tercium dari reaksi
tersebut dan hanya terjadi kenaikan suhu serta larutannya menjadi homogen.
Pada butil asetat, umumnya
diproduksi oleh esterifikasi Fischer dari isomer butanol
dan asam asetat dengan adanya katalis asam sulfat. Sehingga dari
hasil percobaan diperoleh aroma ester dan pada campuran larutan terdapat 2 fasa, yaitu : fasa atas minyak dan fasa bawah
air.
VII. KESIMPULAN
ü Asam salisilat merupakan asam karboksilat yang tidak
dapat larut dengan air tetapi asam salisilat larut dengan NaOH
ü Pada esterifikasi
dibuat dengan cara mereaksikan asam karboksilat dan alkohol dengan bantuan
katalis. Ester memiliki aroma yang khas
I. VIII. DAFTAR PUSTAKA
Fessenden. 1982. Kimia Organik Edisi Ketiga Jilid 1. Jakarta: Erlangga.
Riawan, S. 1990. Kimia Organik Edisi 1. Binarupa Aksara. Jakarta.
http://annisanfushie.wordpress.com/2009/01/02/asam-karboksilat/ (19 Oktober 2012, pukul 19:24 wib)
http://www.chem-is-try.org/materi_kimia/sifat_senyawa organik /alkohol1/reaksi_pengesteran _esterifikasi/ (19 Oktober 2012, pukul 19:30 wib)
http://www.scribd.com/doc/92786025/46/SIFAT-FISIKA-ASAM-KARBOKSILAT (17 Oktober 2012, pukul 22:00 wib)
http://mel-rizky.blogspot.com/2011/12/kinetika-reaksi-saponifikasi-etil.html
(19 Oktober 2012, pukul 19:42 wib)
www.chemguide.co.uk(17 oktober 2012, pukul 21:50)
http://kabupatenwonogiri.com/laboratorium-laporan-praktikum-esterifikasi
(Diunduh pada tanggal : 17 Oktober 2012, pukul 21:47 wib)
IX. LAMPIRAN
Pertanyaan :
1. Sebutkan cara-cara produksi ester
selain dengan cara esterifikasi menggunakan alkohol dan karboksilat
Jawab :
·
Reaksi antara asil klorida dengan alcohol atau fenoL
· Reaksi antara suatu anhidrida asam dengan fenol
2. Mengapa HCl pekat atau NaOH tidak
bisa menjadi katalis dalam reaksi esterifikasi ?
Jawab : Karena HCl dan NaOH tidak dapat mendonorkan 2 proton pada
saat mekanisme esterifikasi yaitu proses protonasi.
3. Jelaskan mengapa penambahan HCl, ion
salisilat menjadi tidak larut ?
Jawab : karena terjadi reaksi saponifikasi,
proses terbentuknya sabun yang ketika ditambahkan dengan NaOH endapan salisilat
larut, kemudian ditambahkan HCl untuk membentuk garam dan pengasaman
karboksilat menjadi asam karboksilat (asam salisilat) kembali.