Percobaan ke-3
Senin, 12 November 2012
I.
TUJUAN
Ø Menyelidiki sifat-sifat fisik, kelarutan dan massa
jenis senyawa hidrokarbon
Ø Membandingkan kereaktivan antara alkana, alkena dan
senyawa aromatik
Ø Menggunakan sifat fisika dan sifat kimia untuk
mengidentifikasi senyawa yang tidak diketahui (unknow).
II.
DASAR
TEORI
Senyawa organik hanya mengandung atom hydrogen dan
karbon yang disebut hidrokarbon. Hidrokarbon dapat dikelompokan sebagai berikut
:
Sifat fisik yang dimiliki hidrokarbon disebabkan oleh
sifat non polar dari semnyawa tersebut. Umumnya hidrokarbon tidak dapat bercampur
dengan pelarut polar seperti air dan etanol. Sebaliknya, hidrokarbon dapat
bercampur dengan pelarut yang relative non polar seperti karbon tetraklorida
(CCl4) atau diklorometana (CH2Cl2).
Reaktivitas kimia senyawa hidrokarbon ditentukan oleh jenis ikatannya.
Hidrokarbon jenuh (alkana) tidak resktif terhadap sebagian besar pereaksi.
Hidrokarbon tak jenuh (alkena dan alkuna), dapat mengalami reaksi adisi pada
ikatan rangkap dua atau rangkap tiganya. Senyawa aromatic biasanya mengalami
reaksi substitusi.
Reaksi yang terjadi pada hidrokarbon :
a. Pembakaran
Hasil pembakaran hidrokarbon adalah CO2 dan
H2O
CH4 + 2 O2 →
CO2 + 2 H2O
b. Reaksi Bromin
Hidrokarbon tek jenuh bereaksi cepat dengan bromine
dalam larutan CCl4. Reaksi yang terjadi adalah adisi bromin pada
karbon ikatan rangkap.
Br Br
│ │
CH3-CH=CH-CH3 +
Br2 ® CH3-CH-CH-CH3
Merah
tidak berwarna
Br Br
│ │
CH3-C º C-CH3 +
2 Br2 ® CH3-C ¾ C-CH3
merah
│
│
Br
Br
Tidak
berwarna
Larutan bromin berwarna merah kecoklatan, sedangkan
hasil reaksinya tidak berwarna. Sehingga terjadinya reaksi ini ditandai dengan
hilangnnya larutan bromin. Alkana yang tidak memiliki ikatan rangkap, tidak
bereaksi denga bromin (warna merah kecoklatan bromin tetap ada), sedangkan
senyawa aromatik dapat mengalami reaksi substitusi dengam bromin dengan adanya
katalis Fe atau AlCl3. Reaksi substitusi tersebut juga menghasilkan
gas HBr.
c. Reaksi dengan H2SO4
pekat
Hidrokarbon tak jenuh mengalami reaksi adisi dengan H2SO4pekat
dingin. Produk yang dihasilkan adalah asam alkil sulfonat yang larut dalam H2SO4.
H OSO2OH
│ │
CH3-CH-CH-CH3 +
HOSO2OH ® CH3-CH-CH-CH3
(H2SO4)
Hidrokarbon tak jenuh dengan H2SO4 pekat
tidak bereaksi, sedangkan alkuna dan senyawa aromatic bereaksi lambat.
d. Reaksi dengan KMnO4
(uji Baeyer)
Larutan KMnO4 mengoksidasi senyawa tak
jenuh. Alkana dan senyawa aromatik umumnya tidak reaktif dengan KMnO4.
Terjadinya reaksi ini ditandai dengan hilangnya warna ungu dari KMnO4 dan
terbentuknya endapan coklat MnO4. Produk yang dihasilkan suatu
glikol atau 1,2-diol.
OH
OH
│
│
3 CH3-CH-CH-CH3 + 2 KMnO4 +
4 H2O ® 3
CH3-CH-CH-CH3 + 2 MnO4 + 2 KOH
Ungu
coklat
I.
ALAT
DAN BAHAN
Peralatan :
·
Tabung reaksi.
·
Pipet tetes.
·
Batang penggaduk.
·
Kaca arloji.
·
Gelas piala.
·
Gelas ukur.
Bahan :
·
Sikloheksana.
·
Toluen.
·
Senyawa unknow.
·
H2SO4 pekat.
·
Br2 1% dalam heksana.
·
Minyak tanah.
·
KmnO4 1%.
II.
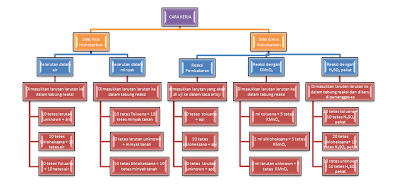
CARA
KERJA
III.
HASIL
PERCOBAAN
IV.
PEMBAHASAN
Percobaan kali ini bertujuan
untuk mengidentifikasi sutu senyawa hidrokarbon berdasarkan sifat fisik dan
kimia yang dimiliki senyawa tersebut.
Berdasarkan hasil percobaan
untuk sifat fisik yang ingin diketahui dari percobaan ini adalah kelarutan
senyawa hidrokarbon (sikloheksana, toluena, unknown) tersebut dalam pelarut
polar dan non polar. Dari percobaan yang telah dilakukan, diketahui bahwa
senyawa hidrokarbon tidak larut dalam aquadest, dimana diketahui bahwa aquadest
adalah pelarut polar. Pada reaksi tersebut, terbentuk dua fasa dimana aquadest
dibawah, dan senyawa hidrokarbon diatas. hal ini karena perbedaan massa jenis
senyawa hidrokarbon yang lebih kecil dari aquadest. Sedangkan dalam
minyak tanah yang diketahui merupakan senyawa non polar, senyawa hidrokarbon
tersebut dapat larut. Oleh karena itu, dapat disimpulkan bahwa senyawa
hidrokarbon bersifat non polar, karena kelarutannya dengan pelarut non
polar.
Sedangkan untuk sifat kimia,
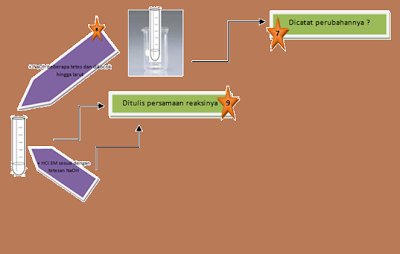
di identifikasi dengan penambahan larutan KMnO4 sebanyak 5 tetes dan
H2SO4
pekat 10 tetes serta di uji dengan proses pembakaran. Berdasarkan hasil
percobaan diperoleh bahwa sikloheksan dan toluena ketika ditambahkan dengan KMnO4 tidak dapat larut dan terdapat dua
fasa yaitu, dibagian atas adalah larutan senyawa sedangkan di bawah adalah
larutan KM nO4 sedangkan pada senyawa unknown terjadi pencampuran
larutan yang menjadikan larutan unknown tersebut larut dengan KMnO4 dan
warnanya menjadi ungu. Kemudian ketika penambahan H2SO4
pekat semua senyawa hidrokarbon terjadi perubahan suhu menjadi eksoterm yang dikarenakan terjadinya reaksi dengan H2SO4
pekat, akan tetapi pada sikloheksana larutan tersebut larut, pada toluena
terdapat endapan putih yang apabila didiamkan endapan tersebuut hilang atau
larut karena telah habis bereaksi dengan H2SO4 pekat dan
pada senyawa unknown larutannya tidak dapat larut sehingga terdapat 2 fasa
yaitu, pada bagian atas merupakan senyawa unknown sedangkan yang dibawah adalah
H2SO4 pekat. Lalu pada proses pembakaran dihasilkan nyala
pembakaran yang berbeda-beda, untuk sikloheksana ketika dibakar nyala apinya
cepat dan warna apinya orange hal ini dikarenakan sikloheksana cepat menguap
sehingga ketika dibakar hanya terdapat api kecil, kemudian pada toluena ketika
dibakar nyala api besar dan lama serta terdapat asap hitam yang kemudian
menghanguskan wadah yang digunakan dan pada senyawa unknown terdapat api sedang
berwarna orange yang menghasilkan asap hitam sedikit tetapi tidak menghanguskan
wadah yang digunakan.
Dari hasil identifikasi
percobaan yang telah dilakukan dapat diketahui bahwa senyawa unknown yang diuji
senyawa hidrokarbon ikatan tak jenuh. Karena pada uji ini menunjukan adanya reaksi
eksoterm dimana terjadi reaksi adisi yang menunjukan ikatan karbon dalam
keadaan tak jenuh.
I.
KESIMPULAN
Senyawa toluena dan sikloheksana adalah ikatan hidrokarbon jenuh
Senyawa unknown adalah ikatan hidrokarbon tak jenuh
II.
DAFTAR
ISI
Nurbayti,siti
Msi. 2012.”penuntun praktikum Kimia Organik I”. Jakarta : UIN Syarif Hidayatullah
http://abie-moonshine.blogspot.com/2011/11/laporan-identifikasi-senyawa.html
(di unduh pada tanggal 27 oktober 2012 pukul 15:30 wib)
http://choesnanmoesthofa.wordpress.com/2012/04/01/mangan-mn
(di unduh pada tanggal 27 oktober 2012 pukul 15:32 wib)